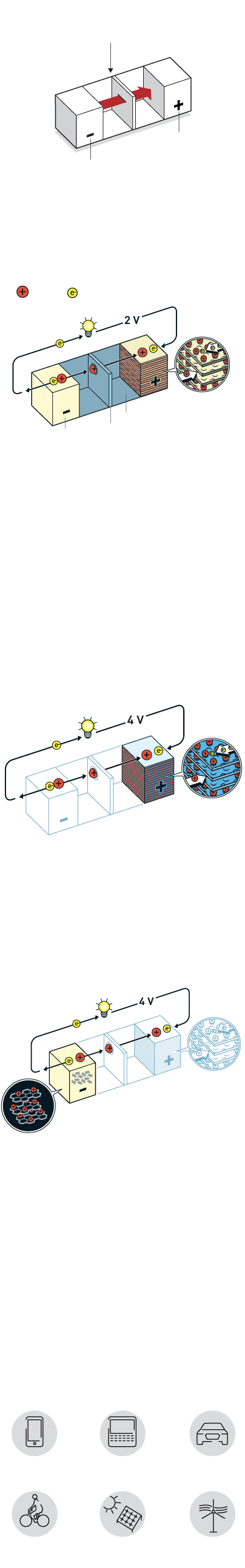
O FUNCIONAMENTO BÁSICO DE UMA BATERIA SE DÁ COM O FLUXO DE ELÉTRONS DE UM ELETRODO NEGATIVO (O ÂNODO) PARA UM ELETRODO POSITIVO (O CÁTODO)
CÁTODO
ÂNODO
Modelo de Stanley Whittingham
A primeira versão da bateria de lítio surgiu nos anos 1970, com lítio metálico do lado negativo e dissulfeto de titânio do lado positivo
ELÉTRON
ION DE LÍTIO
DISSULFETO
DE TITÂNIO
CÁTODO
ELETROLITO
BARRIER
ÂNODO
LÍTIO METÁLICO
Whittingham descobriu que esse material tem camadas que permitem intercalar íons de lítio, que poderiam se movimentar de um lado para o outro gerando
energia e também permitindo a recarga. O modelo, que gerava 2 volts de energia, porém, era muito instável, podendo explodir
Modelo de John Goodenough
O pesquisador conseguiu dobrar a voltagem da bateria para 4 volts ao trocar o sulfeto de metal por óxido de metal. Em 1980, ele demonstrou que o óxido de cobalto com íons de lítio intercalados poderia produzir até 4 volts. Foi um passo decisivo em direção à revolução sem fio
ÓXIDO DE COBALTO
Modelo de Akira Yoshino
O pesquisador foi bem-sucedido em eliminar o lítio puro da bateria, trabalhando somente com os íons de lítio, que são mais seguros. Ele usou o modelo de Goodenough com óxido de cobalto como cátodo e substituiu o ânodo de lítio metálico por coque de petróleo, subproduto da indústria de petróleo
ÓXIDO DE COBALTO
COQUE DE PETRÓLEO
Quando ele carregou o coque de petróleo com elétrons, os íons de lítio foram atraídos para o material. Ao ligar a bateria, os elétrons e os íons de lítio fluíram em direção ao óxido de cobalto no cátodo
A bateria é estável, leve, possui alta capacidade e produz notáveis quatro volts. A maior vantagem dessa bateria é que os íons são intercalados nos eletrodos
Quando uma bateria de íons de lítio é carregada ou usada, os íons fluem entre os eletrodos sem reagir com o ambiente. Isso confere uma vida útil longa e a capacidade de recarregar centenas de vezes antes de deteriorar
Aplicações
Essas baterias hoje são usadas em:
LAPTOPS
CARROS
TELEFONES CELULARES
BICICLETAS ELÉTRICAS
ARMAZENAMENTO DE ENERGIA GERADA POR FONTES COMO SOLAR E EÓLICA
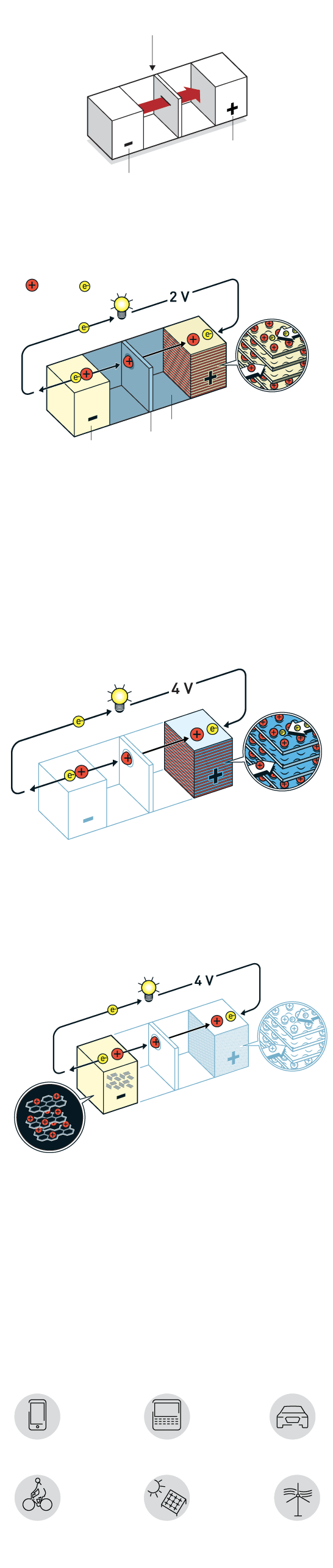
O FUNCIONAMENTO BÁSICO DE UMA BATERIA SE DÁ COM O FLUXO DE ELÉTRONS DE UM ELETRODO NEGATIVO (O ÂNODO) PARA UM ELETRODO POSITIVO (O CÁTODO)
CÁTODO
ÂNODO
Modelo de Stanley Whittingham
A primeira versão da bateria de lítio surgiu nos anos 1970, com lítio metálico do lado negativo e dissulfeto de titânio do lado positivo
ELÉTRON
ION DE LÍTIO
DISSULFETO DE TITÂNIO
CÁTODO
ELETROLITO
BARRIER
ÂNODO
LÍTIO METÁLICO
Whittingham descobriu que esse material tem camadas que permitem intercalar íons de lítio, que poderiam se movimentar de um lado para o outro gerando
energia e também permitindo a recarga. O modelo, que gerava 2 volts de energia, porém, era muito instável, podendo explodir
Modelo de John Goodenough
O pesquisador conseguiu dobrar a voltagem da bateria para 4 volts ao trocar o sulfeto de metal por óxido de metal. Em 1980, ele demonstrou que o óxido de cobalto com íons de lítio intercalados poderia produzir até 4 volts. Foi um passo decisivo em direção à revolução sem fio
ÓXIDO DE COBALTO
Modelo de Akira Yoshino
O pesquisador foi bem-sucedido em eliminar o lítio puro da bateria, trabalhando somente com os íons de lítio, que são mais seguros. Ele usou o modelo de Goodenough com óxido de cobalto como cátodo e substituiu o ânodo de lítio metálico por coque de petróleo, subproduto da indústria de petróleo
ÓXIDO DE COBALTO
COQUE DE PETRÓLEO
Quando ele carregou o coque de petróleo com elétrons, os íons de lítio foram atraídos para o material. Ao ligar a bateria, os elétrons e os íons de lítio fluíram em direção ao óxido de cobalto no cátodo
A bateria é estável, leve, possui alta capacidade e produz notáveis quatro volts. A maior vantagem dessa bateria é que os íons são intercalados nos eletrodos
Quando uma bateria de íons de lítio é carregada ou usada, os íons fluem entre os eletrodos sem reagir com o ambiente. Isso confere uma vida útil longa e a capacidade de recarregar centenas de vezes antes de deteriorar
Aplicações
Essas baterias hoje são usadas em:
LAPTOPS
CARROS
TELEFONES CELULARES
BICICLETAS ELÉTRICAS
ARMAZENAMENTO DE ENERGIA GERADA POR FONTES COMO SOLAR E EÓLICA
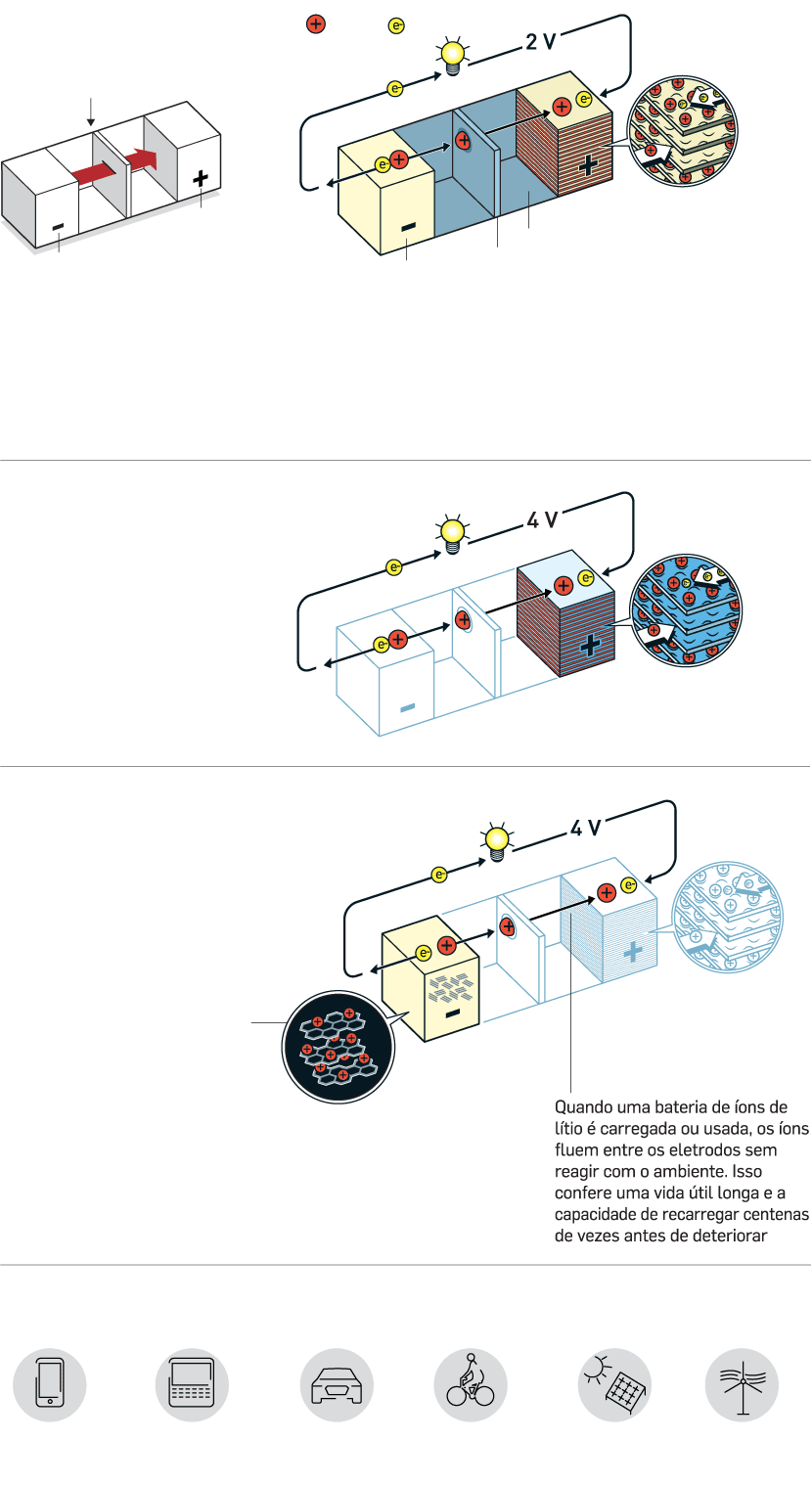
O FUNCIONAMENTO BÁSICO DE UMA BATERIA SE DÁ COM O FLUXO DE ELÉTRONS DE UM ELETRODO NEGATIVO (O ÂNODO) PARA UM ELETRODO POSITIVO (O CÁTODO)
ELÉTRON
ION DE LÍTIO
DISSULFETO DE TITÂNIO
CÁTODO
CÁTODO
ELETROLITO
BARRIER
ÂNODO
ÂNODO
Modelo de Stanley Whittingham
LÍTIO METÁLICO
A primeira versão da bateria de lítio surgiu nos anos 1970, com lítio metálico do lado negativo e dissulfeto de titânio do lado positivo
Whittingham descobriu que esse material tem camadas que permitem intercalar íons de lítio, que poderiam se movimentar de um lado para o outro gerando
energia e também permitindo a recarga. O modelo, que gerava 2 volts de energia, porém, era muito instável, podendo explodir
Modelo de John Goodenough
O pesquisador conseguiu dobrar a voltagem da bateria para 4 volts ao trocar o sulfeto de metal por óxido de metal. Em 1980, ele demonstrou que o óxido de cobalto com íons de lítio intercalados poderia produzir até 4 volts. Foi um passo decisivo em direção à revolução sem fio
ÓXIDO DE COBALTO
Modelo de Akira Yoshino
O pesquisador foi bem-sucedido em eliminar o lítio puro da bateria, trabalhando somente com os íons de lítio, que são mais seguros. Ele usou o modelo de Goodenough com óxido de cobalto como cátodo e substituiu o ânodo de lítio metálico por coque de petróleo, subproduto da indústria de petróleo
ÓXIDO DE COBALTO
COQUE DE PETRÓLEO
Quando ele carregou o coque de petróleo com elétrons, os íons de lítio foram atraídos para o material. Ao ligar a bateria, os elétrons e os íons de lítio fluíram em direção ao óxido de cobalto no cátodo
A bateria é estável, leve, possui alta capacidade e produz notáveis quatro volts. A maior vantagem dessa bateria é que os íons são intercalados nos eletrodos
Aplicações
Essas baterias hoje são usadas em:
LAPTOPS
CARROS
BICICLETAS ELÉTRICAS
ARMAZENAMENTO DE ENERGIA GERADA POR FONTES COMO SOLAR E EÓLICA
TELEFONES CELULARES